ISO9001(品質マネジメントシステム:QMS)
ISO 9001は品質マネジメントシステムに関する国際規格です。
最も普及しているマネジメントシステム規格であり、全世界で170ヵ国以上、100万以上の組織が利用しています。
- ISO9001
TOP - 品質マネジメントシステム内部監査の構築方法・ポイント
- 取得の流れ・更新審査と
認定範囲情報について - ISO9001に関する
よくあるご質問 - 品質マネジメントシステムに関する基礎知識
- 実績・事例
CASE.3
【連載:効果的な運用事例 マルコム 様 [ISO13485/9001]】
医療機器を対象にしたMD-QMS/QMS
海外のお客様にも対応できる製品認証を目指す

取材先:株式会社マルコム
商品企画室 部長 稲毛 剛 様
株式会社マルコム様(本社 東京都渋谷区本町4-15-10 URL https://www.malcom.co.jp)では、電子機器の製造販売を主な事業としていましたが、顧客の要望により海外展開することになりISO13485の取得を目指しました。この国際規格は、医療機器の設計、製造、据付及び付帯サービス並びに関連するサービスの設計、開発及び提供を事業内容とする医療機器産業にたずさわる組織を対象としたものです。
2018年、同社はISO13485 の認証取得を果たし、2019年にはすでに取得していたISO9001との統合審査を受けています。それに伴いマニュアル類のデジタルによる一元管理化と諸ルールの徹底を加速させています。今回、認証取得を巡る一連の取り組みを同社商品企画室部長・稲毛剛様にうかがいました。
1.海外展開を視野に情報収集から着実に進める
医療機器の品質を安定的に確保するために開発された国際規格・ISO13485認証を取得したねらいについてお願いします。
ISO 認証については、2000年にISO9002を取得し、制度変更に伴い翌年にISO9001に変更しています。その後、時間をおいて2018年3月にISO13485認証を取得しています。
当社では、以前から電子機器事業をすすめてきましたが、バイオ関連機器の製品を手がけることになり秦野工場でさまざまなサンプルから核酸を自動で検出する「自動核酸抽出器」を製造していました。それに伴って薬事法に基づいて製造業者としての登録を行っています。
この際、ISO13485の情報を入手しまして、将来のビジネスの可能性を見据えて取得した方が良いと判断したのです。
当時、「自動核酸抽出器」は登録なしで販売できました。しかし、お客様から同製品を海外で販売したいという要望を受け、ISO13485取得のための情報収集を進めていました。ただしすぐに取得には踏み切りませんでした。
血糖数値を表すことで血糖管理状態が把握できる「ヘモグロビンHbA1c測定器」は、当社が自社の意向で開発したというより、海外のお客様のニーズから生みだした製品です。最初は海外の医薬品の許認可を取得して、安全試験も実施しました。そのときに、ISO13485の話がまた浮上したのです。
結局、取得に踏み切ったきっかけは、別のお客様の依頼で、医療機器につないで使用するチューブ(容器)と呼ばれる製品を製造したことです。大量購入の条件として、ISO13485を取得して欲しいということになったのです。いろいろ経緯があり、チューブ自体は対象には入りませんでした。ただ、当社として取得していれば今後、グローバルのビジネス展開につながるということで、「自動核酸抽出器」と「ヘモグロビンHbA1c測定器」のみを認証の対象とする判断をしています。
2.助成金取得のチャンスに審査機関も一新
ISO13485認証取得までのスケジュールは?
この国際規格はもともと規制目的で開発されたものでベースはISO9001と聞いています。そこでISO9001の仕組みをベースにシステム構築の取り組みを進めました。「顧客満足」と「継続的改善」は医療機器の規制になじまないという理由で除外されていますが、ISO9001をベースに加わった要求事項に対応したシステムを構築して対応していきました。
対応作業としては、まずドキュメント(ISO13485対応の品質マニュアル)を作るところからはじまりました。すでに製品を医療機器として販売していたことなどから、弊社では薬剤師を採用していました。薬剤師が認証関連の実務の実績があったので、薬剤師中心にマニュアルの手直しを行っています。具体的には、ISO9001の品質マニュアルを医療機器の内容を盛り込んだ形で加筆・修正していきました。
この取り組みは2015年からはじめて2017年春の時点で原型はできあがっています。同じタイミングで、東京都の助成金の利用の手続きや審査機関からの見積りの取り寄せなどをはじめました。当時は別の審査機関でISO9001を取得していたので、その機関に見積もりを依頼しました。金額は助成金ありきのものでしたが、予算を含めて当社の希望とは離れていたので、別途、日本能率協会審査登録センター(JMAQA)に、ISO13485認証を取得したいと連絡を取ることにしたのです。
いろいろ話を聞いてみると、私どものニーズに合っていたことが分かり、JMAQAでISO13485認証の取得を決定して2016年11月には取り組みを本格的にスタート、2018年春に取得という目標で、仕組みの構築作業を進めました。
3.業務内容を変えずにISO9001との統合で効率化を図る
ISO13485の取得は2018年3月ですね。取得前後についてご紹介ください。

マニュアルの作成により、手順の明確化は行っていますが、現状をできるだけ変えずにシステムを構築するスタンスをとっていました。そのため、基本的に業務に大きな差は生じていません。
また、ISO13485は2013年版の時は、薬事法とイコールと考えてよいと思いますが、2016年版になって、薬事法とのズレが生じました。そのため、取り組みの途中から2016年版対応に変更しています。たとえばISO13485の要求事項と薬事法の中で、整合性がとれなかった部分を付属書をつけることで対応しています。
審査機関の変更について教えてください。
ISO9001については、以前の審査機関で2017年まで毎年、定期的に審査を受けていました。その後、移転することを決めて、2018年10月にJMAQAによる移転審査を受けています。
ISO13485は、2018年2月にJMAQAの登録審査を受けています。その後、統合したほうが効率的と考え、2019年2月のISO13485の定期審査の際、ISO9001の定期審査も加えた統合審査を受けています。今後は毎年同じ時期に統合審査を受ける予定です。
当初はISO13485とISO9001について、別々に年に2回、それも2つの審査機関による審査を受けてみました。やはり業務的に負荷が高かったので、同じ審査機関にして、かつ統合審査にすることで負担が大幅に軽くなりました。
4.業務プロセスから要求事項を見ていく審査員に期待
JMAQAの審査についてお願いします。
以前の審査機関の時代には要求事項から杓子定規に審査を進めるケースがあって、やりにくかったことがありました。JMAQAの審査では、こちらの業務を理解しようと努めてくれており、業務のプロセスからどの要求事項にあてはまるトピックなのかと推し量ってくるので、現場にとっても分かりやすく、役立つ内容だと感じています。
ISO13485に対応したシステムを導入して改善されたことを教えてください。
実務的な面で変化といえば、当社は伝統的に書類の管理があまり得意ではありませんでしたが、マニュアルを作ったことから、記録をきっちり取るようになりました。いまやっていることを崩さずに要求事項を満たす作りにしたので、記録を取る、ルールを守るなどの点で改善が見られました。その一方で、それらにしばられるような状態にはなっていません。現場にあったバランスがとれた仕組みになっていると思います。
5.会社としてではなく、製品自体をスコープ内に入れる
今後の課題は何ですか。
ISO13485に関しては、チューブで認証取得を目指したのですが、のちに立ち消えになってしまいました。しかし、別のお客様から同じ製品の製造依頼が来ました。今度はチューブを直接、適用範囲に入れて欲しいとのことでした。今度の審査で、チューブもスコープに入れることを検討しています。
また、社内的には、規格の運用とともに、ペーバーレスを進めています。マニュアル類はすべて電子化しています。下位文書は審査の都度、修正や入れ替え作業がありますから、電子で一元管理した方が効率的だと考えています。
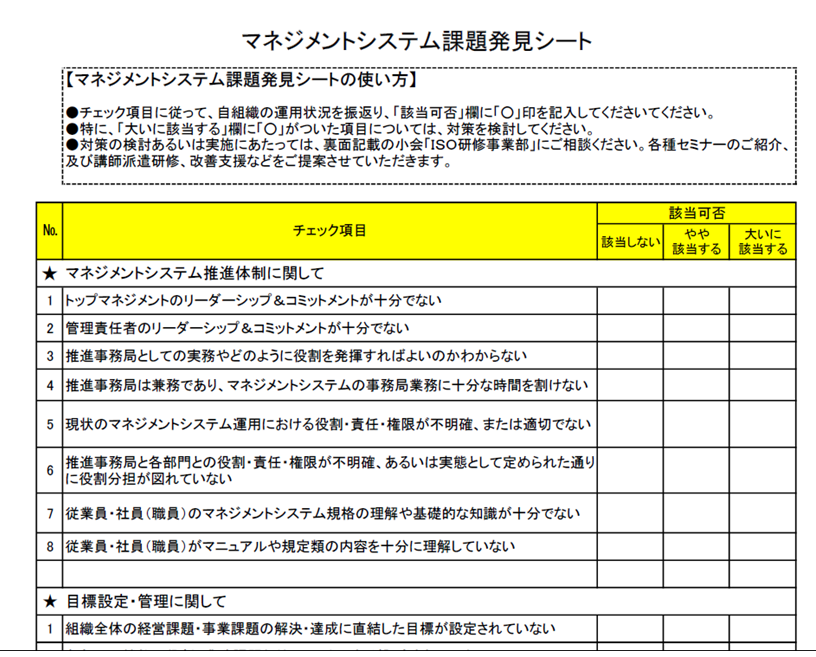
ISOの改善のためのツール「課題発見シート」
MSの弱点・課題を克服するための処方箋「課題発見シート」をご提供しています。ご自身で課題を見つけだすセルフチェックシートで、内部監査に関連する項目も載っています。ぜひともシートを使って課題を抽出し、改善に向けて取り組んでください。
ISO9001についての
お問い合わせはこちら
ISO9001についての無料お見積り
ISO9001についてのお問い合わせはこちら
ISO9001(品質マネジメントシステム:QMS)の認証取得事例について
ISO9001(品質マネジメントシステム)の認証に関する取得事例インタビューを掲載しております。日本能率協会では、インタビュー内にもあるように、様々なニーズやお悩みに対して幅広くご提案をすることが可能です。
新規取得、切り替えをご検討中の企業担当様は是非ごらんください。











 無料ウェビナー
無料ウェビナー 資料
資料 無料
無料 メルマガ登録
メルマガ登録 お問い
お問い